Enlace covalente no polar
Enlace covalente no polar
Enlace covalente no polar
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
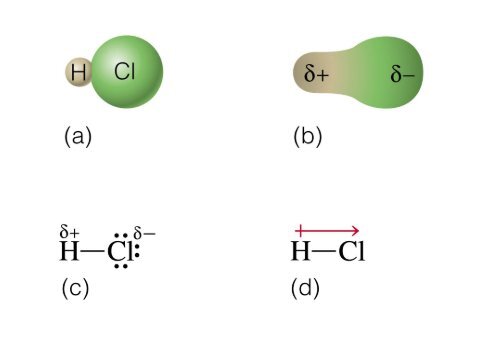
<strong>Enlace</strong> <strong>covalente</strong> <strong>polar</strong><br />
Los electrones del enlace son atraídos más fuertemente<br />
por el Cl que por el H
<strong>Enlace</strong> <strong>covalente</strong> <strong>no</strong> <strong>polar</strong><br />
Los electrones se comparten p de<br />
igual manera<br />
Diferencia de<br />
electronegatividades<br />
ionic_vs_covalent.swf<br />
<strong>Enlace</strong> <strong>covalente</strong> <strong>polar</strong> <strong>Enlace</strong> iónico<br />
Los electrones se comparten p de Los electrones se<br />
manera desigual transfieren<br />
Aumenta el carácter iónico
nico<br />
ácter ió<br />
de cará<br />
centaje<br />
Porc<br />
Diferencia de electronegatividad
Iónico<br />
(especies cargadas)<br />
Covalente <strong>polar</strong><br />
(cargas parciales)<br />
Covalente <strong>no</strong> <strong>polar</strong><br />
(electrónicamente simétricas)
Polarizabilidad (α): ): medida de la tendencia a distorsionarse<br />
dde una nube b electrónica l t ó i al l ser sometida tid a un campo eléctrico. lé t i<br />
EEspecies i <strong>polar</strong>izables: l i bl SSon aquellos ll át átomos cuya nube b<br />
electrónica experimenta fácilmente grandes deformaciones.<br />
Especies <strong>polar</strong>izantes: Son átomos o iones que pueden inducir<br />
grandes g deformaciones en las nubes electrónicas de otros<br />
átomos o iones.<br />
catión<br />
<strong>polar</strong>izante<br />
nube electrónica<br />
distorsionada<br />
anión<br />
<strong>polar</strong>izable
Modelo<br />
iónico<br />
Aumento de la<br />
diferencia de<br />
electronegatividad<br />
Modelo<br />
<strong>covalente</strong><br />
Modelo<br />
iónico<br />
Aumento del poder<br />
<strong>polar</strong>izante del catión y de<br />
la <strong>polar</strong>izabilidad del anión.<br />
Modelo<br />
<strong>covalente</strong>
Estructura de Lewis de moléculas poliatómicas
Geometría molecular.<br />
Las estructuras de Lewis <strong>no</strong> indican la forma de las moléculas, sólo<br />
indica el número y tipo de enlaces.<br />
Longitud de enlace C-Cl: 1.78 A<br />
Ángulo de enlace: 109,5º
H<br />
H<br />
H<br />
H<br />
Compuestos del tipo AB n
AB<br />
AB 2<br />
AB 3<br />
SO SO3 NH NH3
Geometrías moleculares<br />
lineal angular triangular plana pirámide<br />
ti triangular l<br />
d d l<br />
hamaca cuadrado plana bipirámide<br />
triangular<br />
pirámide<br />
cuadrada<br />
triangular tetraédrica<br />
octaédrica bipirámide<br />
pentagonal
Teoría de repulsión de pares de electrones de valencia<br />
(TRPEV)<br />
La mejor manera de acomodar pares de electrones es aquella<br />
que minimiza la repulsión.
Posiciones de las regiones g con alta densidad electrónica<br />
bipirámide<br />
triangular<br />
lineal triangular plana tetraédrica<br />
octaédrica bipirámide<br />
pentagonal
AB 4 AB AB3L 3L AB AB2L 2L 2<br />
109,5º 107º 104,5º<br />
meta<strong>no</strong> amoníaco agua<br />
tetraédrica piramidal trigonal<br />
angular
pares de e - <strong>no</strong><br />
enlazantes<br />
pares dde<br />
e- enlazantes<br />
Repulsiión<br />
par libre – par libre<br />
par libre – par enlazante<br />
par enlazante l t – par enlazante l t
•Las regiones g de alta densidad electrónica adoptan p pposiciones qque<br />
maximizan sus separaciones.<br />
•Todos los enlaces (simples (simples, dobles o triples) se repelen de igual<br />
manera.<br />
•El enlace alrededor de un átomo central es independiente de si la<br />
molécula tiene más de un átomo central.<br />
•Los pares solitarios contribuyen a la forma de la molécula<br />
(geometría electrónica), aunque <strong>no</strong> están incluidos en la<br />
descripción de la forma molecular (geometría molecular).<br />
•Los pares solitarios se repelen con mayor intensidad que los<br />
Los pares solitarios se repelen con mayor intensidad que los<br />
pares enlazantes y por lo tanto tienden a comprimir los ángulos de<br />
enlace.
1- Dibujar la estructura de Lewis de la molécula.<br />
2- Identificar la geometría electrónica , contando las regiones con<br />
pares de electrones (los enlaces dobles y triples se cuentan como<br />
una úúnica i región). ió )<br />
3- Ubicar los átomos y clasificar la geometría g molecular.<br />
4- Identificar la intensidad de las repulsiones y permitir que la<br />
molécula se distorsione de acuerdo a ellas ellas.<br />
Recordar que las repulsiones son:<br />
pl – pl > pl – pe > pe – pe
Nº de regiones<br />
electrónicas<br />
Geometría electrónica Ángulo de enlace<br />
lineal<br />
triangular<br />
plana<br />
tetraédrica<br />
bipirámide 054 05 _VSEPR.mov o<br />
base<br />
triangular<br />
octaédrica<br />
Trpev.flv
Polaridad de las moléculas.<br />
Molécula <strong>polar</strong>: molécula con momento di<strong>polar</strong> permanente <strong>no</strong> nulo nulo.<br />
Todas las moléculas diatómicas son <strong>polar</strong>es p si sus enlaces son<br />
<strong>polar</strong>es.<br />
Todas las moléculas diatómicas homonucleares (2 átomos iguales)<br />
son <strong>no</strong> <strong>polar</strong>es, debido a que sus enlaces son <strong>no</strong> <strong>polar</strong>es.<br />
Moléculas poliatómicas:<br />
<strong>Enlace</strong>s <strong>polar</strong>es<br />
<strong>Enlace</strong>s <strong>polar</strong>es<br />
Polares<br />
Asimétricas Simétricas<br />
No <strong>polar</strong>es
<strong>Enlace</strong>s <strong>polar</strong>es <strong>Enlace</strong>s <strong>polar</strong>es<br />
Momento di<strong>polar</strong> p neto (μ)<br />
= 0<br />
Momento di<strong>polar</strong><br />
neto (μ) ≠ 0<br />
Rojo: regiones de mayor densidad electrónica<br />
Azul: regiones de me<strong>no</strong>r densidad electrónica
tipo No <strong>polar</strong> Polar tipo No <strong>polar</strong> Polar tipo No <strong>polar</strong> Polar