El enlace covalente es único tipo de enlace que forma moléculas, lo que hace que el estudio de este tipo de enlace sea mucho más complejo que el de los otros dos. En este tema vamos a ver:
Concepto de enlace covalente.
Un enlace covalente se produce entre dos elementos no metálicos al compartir un par de electrones de su capa de valencia. Al contrario que en el enlace iónico, en el enlace covalente las electronegatividades de los elementos que lo producen no tienen una gran diferencia, sino que son parecidas. Recuerda que la electronegatividad era la tendencia de un elemento a atraer los electrones hacia su núcleo. Esto significa que si las electronegatividades son parecidas, los átomos que forman el enlace van a luchar por los electrones a la vez, quedándose entre los dos núcleos. Un enlace covalente es, en definitiva, la compartición de dos electrones.
Los enlaces covalentes forman dos tipos de estructuras: moléculas y cristales o redes. Las moléculas son uniones de unos «pocos» átomos y solo se dan con el enlace covalente.
Enlace covalente o iónico.
Lo que hace que un enlace sea covalente o iónico es la diferencia de electronegatividad que existe entre los átomos que forman el enlace. De esta forma los enlaces se pueden clasificar como covalentes puros, covalentes polares o iónicos puros.
- Covalente puro. Este tipo de enlace se da cuando la diferencia de electronegatividad es cero o casi cero.
- Covalente polar. Este tipo de enlace se da cuando la diferencia de electronegatividad está entre medias, es decir, no es muy alta ni muy baja. Vamos a tomar como referencia que como mínimo una diferencia de 0’5 y como mucho una de 1’5.
- Iónico puro. Este tipo de enlace se da cuando la diferencia de electronegatividad es muy alta. Yo voy a poner como referencia que sea superior a 1’5.

Ejercicio de tipos de enlace covalente o enlace iónico.
Clasifica los siguientes enlaces en covalentes puros, covalentes polares o iónicos puros.
a) Hidrógeno y cloro.
b) Cloro y cloro.
c) Fluor y oxígeno.
d) Cloro y sodio.
Solucióna) El hidrógeno tiene una electronegatividad de 2’2 según la tabla de electronegatividades de Pauling y el cloro tiene un electronegatividad de 3’0, por lo que la diferencia de electronegatividad es:
![]()
Esto significa que este enlace es covalente polar.
b) El cloro tiene una electronegatividad de 3’0 en la tabla de electronegatividades, por lo que su diferencia de electronegatividad es:
![]()
Esto significa que el enlace es covalente puro.
Este ejercicio se puede resolver sin la necesidad de hallar la diferencia de electronegatividad. Cuando un enlace este entre dos átomos iguales el enlace es siempre covalente puro, ya que las electronegatividades son iguales.
c) El fluor tiene una electronegatividad de 4 en la escala de Pauling y el oxígeno una electronegatividad de 3’5, por lo que la diferencia de electronegatividad es:
![]()
Esto significa que este enlace es covalente polar.
d) El cloro tiene una electronegatividad de 3’0 en la tabla de electronegatividades de Pauling y el sodio tiene 0’93, por lo que la diferencia de electronegatividad es:
![]()
Esto significa que este enlace es iónico puro.
Teoría de Lewis para el enlace covalente.
¿Qués es la teoría de Lewis?
La teoría de Lewis se utiliza para representar moléculas covalentes. Lewis propuso que para que una molécula fuera estable todos los átomos de la molécula debían cumplir la regla del octeto.
Regla del octeto: todos los átomos tienen que tener 8 electrones en su capa de valencia (menos el hidrógeno que tiene que tener 2).
El desarrollo del modelo de Bohr y el descubrimiento de los gases nobles dieron lugar a esta regla del octeto. Los gases nobles eran elementos con una enorme estabilidad atómica y que poseían ocho electrones en su capa de valencia, por lo que Lewis asoció al enlace químico la necesidad de que cada átomo que tuviera ocho electrones en su capa de valencia para poder formar un enlace.
Estructuras de Lewis.
De esta teoría se obtuvieron las estructuras de Lewis que nos ayudan a saber el número de enlaces dentro de las moléculas o que átomos se enlazan entre sí.
Para obtener la estructura de Lewis se utilizan las siguientes fórmulas:
- T: electrones totales (número de electrones que hay en la capa de valencia de cada átomo de la molécula).
- N: electrones necesarios (número de electrones que necesita para cumplir la regla del octeto).
- C: electrones compartidos (electrones que generan enlaces).
- S: electrones solitarios (número de electrones que no forman enlaces).
![]()
![]()
![]()
Para obtener la estructura de Lewis de una molécula seguimos los siguientes pasos:
- Obtenemos las configuraciones electrónicas de cada uno de los átomos que componen la molécula.
- Calculamos el número de electrones necesarios y totales.
- Calculamos el número de electrones compartidos, solitarios y el número de enlaces.
- Ponemos como átomo central el menos electronegativo. Este átomo central no puede ser el hidrógeno. En el caso de tener dos átomos con electronegatividades semejantes se escoge el que más electrones necesite para cumplir la regla del octeto.
- Se unen con un enlace el resto de átomos al átomo central hasta que este cumpla la regla del octeto. Si nos han sobrado átomos se colocan enlazados a los átomos que hemos unido al átomo central.
- Colocamos los electrones solitarios a los átomos que lo necesiten para cumplir la regla del octeto.
- Confirmamos que todos los átomos cumplen la regla del octeto.
1. Obtenemos las configuraciones electrónicas de cada uno de los átomos que componen la molécula.
El carbono tiene Z=6 y el hidrógeno tiene Z=1.
C: 1s2 2s2 2p2
H:1s1
2. Calculamos el número de electrones necesarios y totales.
El número de electrones totales es la suma del número de electrones que hay en la capa de valencia de cada átomo. El carbono tiene 4 electrones de valencia y el hidrógeno 1. Como hay 2 carbonos y 4 hidrógenos el número total de electrones es:
![]()
El número de electrones necesarios es la suma del número de electrones que tendría que tener cada átomo para que cumpliera la regla del octeto (todos tienen que tener ocho excepto el hidrógeno). En nuestro ejercicio el carbono necesita tener 8 y el hidrógeno 2, por lo que los electrones necesarios son:
![]()
3. Calculamos el número de electrones compartidos, solitarios y el número de enlaces.
Para calcular el número de electrones compartidos, solitarios y número de enlaces utilizamos las siguientes fórmulas:
![]()
![]()
![]()
4. Ponemos como átomo central el menos electronegativo. Este átomo central no puede ser el hidrógeno. En el caso de tener dos átomos con electronegatividades semejantes se escoge el que más electrones necesite para cumplir la regla del octeto.
En este caso el átomo central sería el carbono, pero al haber dos los colocamos unidos con un enlace como si fueran los dos átomos centrales.
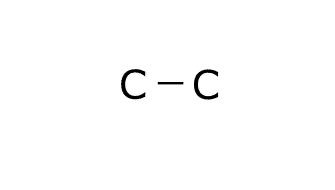
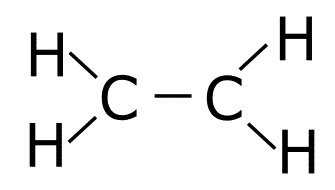
5. Se unen con un enlace el resto de átomos al átomo central hasta que este cumpla la regla del octeto. Si nos han sobrado átomos se colocan enlazados a los átomos que hemos unido al átomo central.
Se colocan dos hidrógenos unidos a cada carbono.
6. Colocamos los electrones solitarios a los átomos que lo necesiten para cumplir la regla del octeto. Colocamos también los enlaces que sobren para que todos los átomos cumplan la regla del octeto formando enlaces dobles o incluso triples.
En este caso el número de electrones solitarios es cero, por lo que no es necesario colocar ningún electrón solitario pero nos sobran dos enlaces que se colocan como un enlace doble entre los carbonos para que cumplan la regla del octeto.
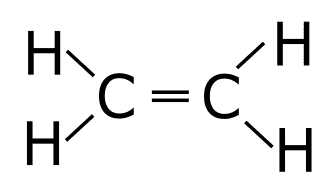
7. Confirmamos que todos los átomos cumplen la regla del octeto.
Todos los átomos cumplen la regla del octeto. Los carbonos tienen ocho electrones y los hidrógenos dos.
Ejercicio resuelto teoría de Lewis (fácil).
Obtener las estructuras de Lewis de N2, H2, O2 y Cl2.
SoluciónEstructura del N2.
N: 1s2 2s2 2p3
![]()
![]()
![]()
![]()
![]()
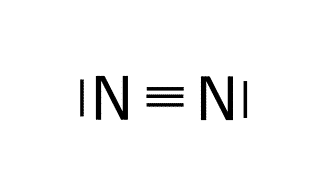
Estructura del H2.
H: 1s1
![]()
![]()
![]()
![]()
![]()
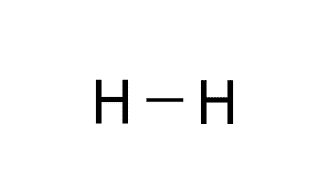
Estructura del O2.
O: 1s2 2s2 2p4
![]()
![]()
![]()
![]()
![]()
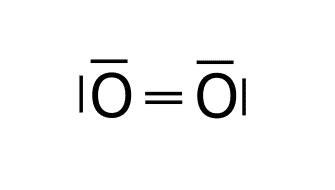
Estructura del Cl2.
Cl: 1s2 2s2 2p6 3s2 3p5
![]()
![]()
![]()
![]()
![]()
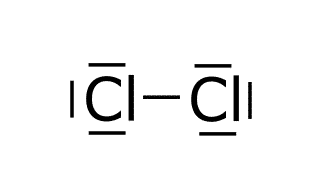
Ejercicio resuelto teoría de Lewis (medio).
Obtener las estructuras de Lewis de NH3, CH4 y H2O.
SoluciónEstructura del NH3.
N: 1s2 2s2 2p3
H: 1s1
![]()
![]()
![]()
![]()
![]()
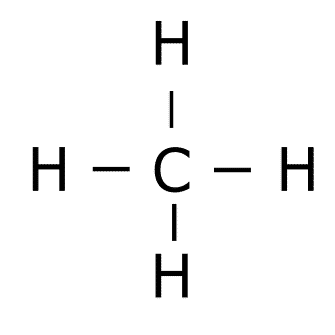
Estructura del CH4.
C: 1s2 2s2 2p2
H: 1s1
![]()
![]()
![]()
![]()
![]()
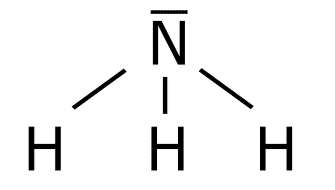
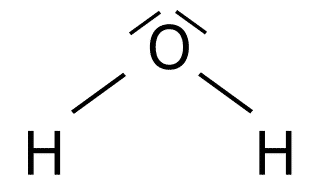
Estructura del H2O.
O: 1s2 2s2 2p4
H: 1s1
![]()
![]()
![]()
![]()
![]()
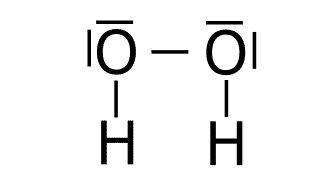
Ejercicio resuelto teoría de Lewis (difícil).
Obtener las estructuras de Lewis de H2O2, HCN y H2CO3.
SoluciónEstructura del H2O2.
O: 1s2 2s2 2p4
H: 1s1
![]()
![]()
![]()
![]()
![]()
Estructura del HCN.
N: 1s2 2s2 2p3
C: 1s2 2s2 2p2
H: 1s1
![]()
![]()
![]()
![]()
![]()
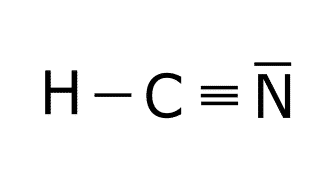
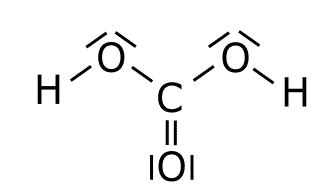
Estructura del H2CO3.
O: 1s2 2s2 2p4
C: 1s2 2s2 2p2
H: 1s1
![]()
![]()
![]()
![]()
![]()
Para obtener la estructura de Lewis del H2CO3 se coloca el carbono en el centro al ser el elemento menos electronegativo. Una vez colocado el átomo central se colocan los tres oxígenos a su alrededor por ser el siguiente elemento en la escala de electronegatividades, es decir, que es el segundo menos electronegativo. Después unimos a dos de los tres oxígenos los hidrógenos. Por último se colocan los enlaces y los electrones solitarios.
Excepciones de la teoría de Lewis.
Tras darse a conocer, la teoría de Lewis se sometió a muchas pruebas y resultó que la regla del octeto no funcionaba en algunos casos. Estos casos son:
- Elementos que cumplen la regla del octeto con más de ocho electrones.
- Elementos que cumplen la regla del octeto con menos de ocho electrones.
- Moléculas que tienen un número impar de electrones totales.
Es muy importante entender que estas excepciones no se dan siempre, sino que se dan en caso de necesitarlo. No por el hecho de que una molécula tenga un elemento que cumpla la regla del octeto con menos ó más de ocho electrones va a cumplir la regla del octeto con más ó menos electrones que ocho.
Elementos que cumplen la regla del octeto con más de ocho electrones.
Los elementos que cumplen la regla del octeto con más de ocho electrones se dice que tienen un octeto ampliado.
Los elementos más comunes que tienen un octeto ampliado son:
- El azufre puede cumplir la regla del octeto con 10 ó 12 electrones.
- El fósforo puede cumplir la regla del octeto con 10 electrones.
El octeto ampliado se forma debido a que el átomo se encuentra en un estado excitado. Un estado excitado se da cuando los electrones no ocupan la posición de mínima energía en su configuración electrónica.
Octeto ampliado del azufre.El azufre tiene esta configuración electrónica 1s2 2s2 2p6 3s2 3p4.
Si representamos la capa de valencia mediante un diagrama de cajas tendremos esto:
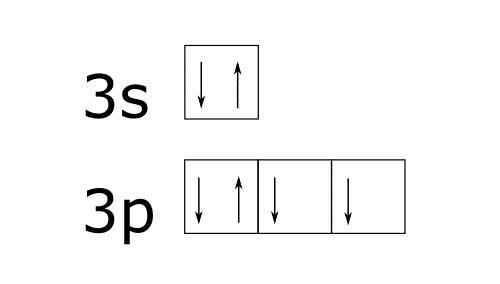
Los electrones en el azufre pueden colocarse también de las siguientes formas si se le aporta a energía al átomo.
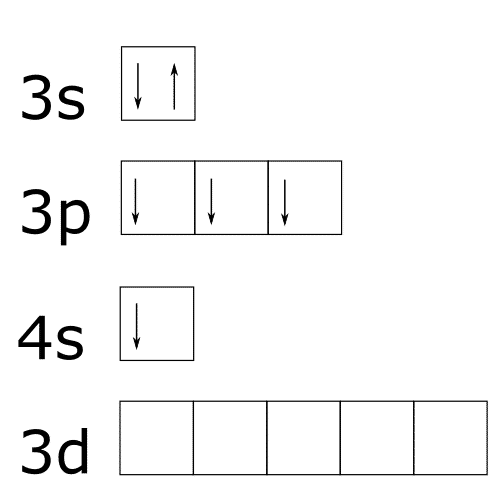
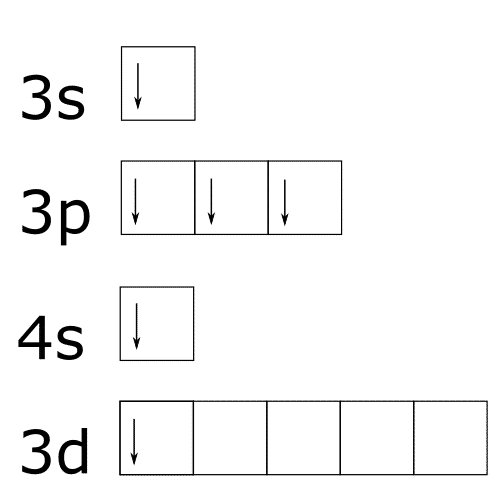
Existen otros elementos que tienen octetos ampliados pero no son tan frecuentes. Para saber que elementos pueden ampliar sus octetos se tienen que cumplir tres condiciones:
- Tener un elevado número de electrones (a partir del periodo tres). De esta forma, el Yodo (I) podría tener un octeto ampliado.
- Poseer orbitales cercanos en energía en los que depositar electrones con los que poder ampliar el número de electrones que pueden formar enlace.
- Es más sencillo que se forme un octeto ampliado si el enlace se produce con un elemento muy electronegativo.
Elementos que cumplen la regla del octeto con menos de ocho electrones.
Los elementos que cumplen la regla del octeto con menos de ocho electrones se dice que tienen un octeto incompleto.
Los elementos más comunes que tienen octeto incompleto son:
- El boro cumple la regla del octeto con seis electrones.
- El aluminio cumple la regla del octeto con seis electrones.
Existen más octetos incompletos pero el resto son elementos metálicos y se darían para estructuras de Lewis en el enlace iónico. Esto sucede con el litio en el Li2O ó con el magnesio en el MgH.
Los octetos incompletos se dan cuando el elemento se encuentra en un estado excitado, al igual que ocurre con los octetos ampliados.
Octeto incompleto del boro.El boro tiene esta configuración electrónica 1s2 2s2 2p6 3s2 3p1.
Si representamos la capa de valencia mediante un diagrama de cajas tendremos esto:
Los electrones en el boro pueden colocarse también de la siguiente forma si se le aporta a energía al átomo.
Moléculas que tienen un número impar de electrones totales.
Existen moléculas como el NO ó el NO2 que tienen un número total de electrones impar, por lo que un electrón va a quedar suelto. Lo más sorprendente es que este tipo de moléculas formadas por enlace covalente existe en la naturaleza, ya que los átomos que las forman son más estables juntos que separados, aunque no tengan una estabilidad ideal.
Estructura de Lewis de NO: 1. Obtenemos las configuraciones electrónicas del nitrógeno y el oxígeno. O: 1s2 2s2 2p4 N: 1s2 2s2 2p3 2. Calculamos electrones totales y necesarios. En la capa de valencia del oxígeno hay 6e– y en la capa de valencia del nitrógeno hay 5e–. El oxígeno y el nitrógeno necesitan 8e– para cumplir la regla del octeto, por lo que los electrones necesarios son: 3. Obtenemos el número de electrones solitarios y el número de enlaces. El número de e– compartidos son: Esto significa que el número de enlaces es: Esto supone un problema, ya que no puede haber 2’5 enlaces. Por ello se obtiene como conclusión que en este caso el nitrógeno cumple la regla del octeto con 7e– y no con 8e–. Esto supone que los electrones necesarios ahora serían 15, por lo que el número de electrones compartidos sería 4, el número de enlaces sería 2 y los electrones solitarios serían: 4. Ponemos los dos átomos (oxígeno y nitrógeno) unidos por un enlace. 5. Dibujamos un doble enlace entre el nitrógeno y el oxígeno para que tenga dos enlaces. 6. Dibujamos los electrones solitarios sabiendo que el nitrógeno cumple el octeto con 7e–. De esta forma se ve como entre el nitrógeno y el oxígeno Estructura de Lewis del NO2: 1. Obtenemos las configuraciones electrónicas del nitrógeno y el oxígeno. O: 1s2 2s2 2p4 N: 1s2 2s2 2p3 2. Calculamos electrones totales y necesarios. En la capa de valencia del oxígeno hay 6e– y en la capa de valencia del nitrógeno hay 5e–. El oxígeno y el nitrógeno necesitan 8e– para cumplir la regla del octeto, por lo que los electrones necesarios son: 3. Obtenemos el número de electrones solitarios y el número de enlaces. El número de e– compartidos son: Esto significa que el número de enlaces es: Esto supone un problema, ya que no puede haber 3’5 enlaces. Por ello se obtiene como conclusión que en este caso el nitrógeno cumple la regla del octeto con 7e– y no con 8e–. Esto supone que los electrones necesarios ahora serían 23, por lo que el número de electrones compartidos sería 6, el número de enlaces sería 3 y los electrones solitarios serían: 4. Ponemos el nitrógeno como átomo central, dado que es el elemento menos electronegativo y los oxígenos uno a cada lado del nitrógeno unidos a este con un enlace. 5. El número de enlaces es 3, por lo que situamos un doble enlace entre el nitrógeno y uno de los oxígenos. Este doble enlace se puede colocar a la derecha o a la izquierda, por lo que tendríamos una estructura resonante. Las estructuras resonantes se ven en el siguiente punto. 6. Dibujamos los electrones solitarios sabiendo que el nitrógeno cumple el octeto con 7e–. Las dos estructuras de Lewis son válidas y se producen simultáneamente gracias a la resonancia. Cuando una molécula tiene dos o más estructuras de Lewis posibles se produce el fenómenos llamado RESONANCIA. La resonancia es el siguiente paso para realizar una correcta representación de una molécula mediante las estructuras de Lewis. Esta tiene lugar cuando los electrones no compartidos o los enlaces múltiples (dobles o triples) pueden cambiar de ubicación dentro de la molécula. Cuando una molécula es resonante se deben representar todas las estructuras de Lewis posibles dibujando una flecha bidireccional entre cada una de las estructuras. O: 1s2 2s2 2s4 A la hora de obtener la estructura de Lewis se colocan los tres átomos de oxígeno unidos por dos enlaces. Tras esto colocamos los enlaces solitarios y los enlaces que quedan, pero el enlace que queda se puede colocar a la derecha o a la izquierda, formando la estructura resonante del ozono. C:1s2 2s2 2p2 H: 1s1 El benceno es un compuesto orgánico cíclico formado por un anillo de seis carbonos. Una vez que se han colocado los carbonos unimos a cada carbono un hidrógeno. Por último colocamos los dobles enlaces par completar los octetos de los carbonos de todas las formas posibles respetando la simetría de la molécula. La estructura del benceno es muy usada en orgánica, por lo que en lugar de expresar todas sus formas resonantes se utiliza esta forma: Dibuje las estructuras de Lewis de la molécula de SO3. a) Las configuraciones electrónicas del azufre y el oxígeno son: S: 1s2 2s2 2p6 3s2 3p4 O: 1s2 2s2 2p4 El número de electrones totales, necesarios, compartidos y solitarios es: Para obtener la estructura de Lewis colocamos el azufre como átomo central, por ser el menos electronegativo, y6 los tres oxígenos alrededor. Tras esto colocamos los enlaces que faltan y los electrones solitarios. Como hay 4 enlaces tendríamos las siguientes estructuras resonantes. En la mayoría de las moléculas formadas por el enlace covalente existe una «descompensación» de la carga en los átomos, generando lo que se denominan cargas formales. La carga formal de un átomo en una molécula se calcula de la siguiente manera: CARGA FORMAL = e– de la capa de valencia – e– que no intervienen en los enlaces – nº de enlaces. El ozono tiene las siguientes estructuras resonantes. Si analizamos las cargas formales tendríamos que construir las siguientes tablas. La primera tabla analiza las cargas forales de los átomos de la molécula de ozono con el doble enlace en la parte derecha(molécula de la izquierda). Una vez que hemos hecho la tabla hay que situar las cargas sobre cada átomo de esta forma: Después tenemos que hacer la segunda tabla. La segunda tabla analiza las cargas forales de los átomos de la molécula de ozono con el doble enlace en la parte izquierda (molécula de la derecha). Una vez que hemos hecho la tabla hay que situar las cargas sobre cada átomo de esta forma: Si juntamos las dos estructuras tenemos la estructura de Lewis completa. El enlace coordinado o enlace dativo se produce cuando el par de electrones que enlaza los dos átomos es aportado por un solo átomo. El enlace coordinado se representa con una flecha con origen en el átomo que aporta los electrones y fin en el que los acepta. Para formar el H3O+ se produce la reacción Para formar el NH4+ se produce la reacción Para formar el Al2Cl6 se produce la reacción Para formar NH3BF3 el se produce la reacción Esta teoría nos aporta el como se enlazan los átomos, no su disposición espacial o el número de enlaces que se producen entre los átomos de una molécula. Según esta teoría una molécula es un conjunto de orbitales, a menudo “híbridos” (la hibridación se trata más adelante), localizados y asociados a cada átomo, y que albergan pares de electrones. Un enlace entre dos átomos se forma por el solapamiento de dos orbitales, uno de cada átomo. Entre los dos orbitales que se solapan para formar un enlace tiene que haber dos electrones.En los enlaces intervienen orbitales con electrones desapareados, aportando cada átomo un electrón con spin opuesto. Esto supone la compartición de electrones para obtener la configuración electrónica que le aporta estabilidad necesaria a cada átomo. Según el tipo de solapamiento que exista entre los orbitales podemos tener dos tipos de enlaces: Esta teoría explicar la geometría de la molécula para el enlace covalente, es decir, la disposición espacial de los núcleos atómicos y por qué estos átomos se colocan así en el espacio. Esta teoría sigue los siguientes puntos: Para obtener la geometría molecular seguimos los siguientes pasos: Para definir la geometría utilizamos la siguiente tabla que hay que aprenderse de memoria: Para las moléculas BF3 y NH3 indique su geometría molecular utilizando la teoría de repulsión de pares de electrones de la capa de valencia. BF3 1. Estructura de Lewis. B: 1s2 2s2 2p1 F: 1s2 2s2 2p5 2. Contamos el número de zonas de enlace y el número de PARES de electrones solitarios del átomo central. El BF3 tiene tres zonas de enlace que son los tres enlaces simples que hay entre el boro y los tres átomos de flúor. No tiene pares de electrones solitarios en el átomo central que sería el boro. 3. Obtenemos la geometría de la molécula con la tabla. La geometría que aparece en la tabla para tres zonas de enlace y ningún par de electrones solitarios es la geometría triangular. NH3 1. Estructura de Lewis. N: 1s2 2s2 2p3 H: 1s1 2. Contamos el número de zonas de enlace y el número de PARES de electrones solitarios del átomo central. El NH3 tiene cuatro zonas de enlace que son los tres enlaces simples que hay entre el nitrógeno y los tres átomos de hidrógeno junto con el par de electrones solitarios que tiene el nitrógeno (recuerda que los pares de electrones solitarios cuentan como zona de enlace). 3. Obtenemos la geometría de la molécula con la tabla. La geometría que aparece en la tabla para cuatro zonas de enlace y un par de electrones solitarios es la geometría pirámide trigonal. La teoría de repulsión entre pares de electrones de la capa de valencia (TRPECV) nos justifica la geometría de la molécula pero no explica la unión que se produce entre orbitales atómicos. La teoría de la hibridación une la teoría del enlace de valencia con la teoría de repulsión entre pares de electrones de la capa de valencia. La hibridación se produce justo antes de la unión entre los átomos que forman la molécula. La hibridación recombina orbitales atómicos puros (s, p, d, f), para dar unos nuevos orbitales híbridos que son una especie de mezcla entre dos o más orbitales “normales”. Estos orbitales se caracterizan por: En un enlace covalente se produce la hibridación de una forma bastante llamativa. Para desarrollar este concepto vamos a utilizar la molécula de metano. Lo primero sería desarrollar la estructura de Lewis de este compuesto. C: 1s2 2s2 2p2 H: 1s1 Una vez que hemos obtenido la estructura de Lewis vamos a ver como se produce esta hibridación. En la estructura de Lewis se ve como el carbono está unido a cuatro hidrógenos. Los hidrógenos se enlazan al carbono con sus orbitales s que es donde está el electrón de valencia que produce el enlace covalente. El carbono sin embargo tiene la siguiente configuración electrónica de cajas. Cómo se puede ver en la imagen el carbono solo tiene disponibles para enlazar dos electrones, pero esto se puede solucionar excitando el átomo (aportándole energía). Al excitar el átomo, uno de os electrones del orbital 2s va a ir a ocupar el orbital que está vacío del 2p. Ahora que hemos resuelto el problema del número de electrones disponibles vamos a ver como sería esta molécula si dibujáramos sus orbitales siguiendo la teoría del enlace de valencia (TEV). Como puede verse el enlace que une los orbitales 1s del hidrógeno y el 2s del carbono quedan superpuestos con otros orbitales (está señalado con una flecha en el dibujo) y la unión se hace casi imposible. Si además de esto obtenemos la distribución de los átomos en esta molécula experimentalmente el resultado no se parece en nada a esto, por lo que se tendrá que producir una modificación en los orbitales para que la geometría que se obtiene experimentalmente si concuerde con lo obtenido en la teoría. Lo que sucede entonces es la hibridación. Cuando se produce la hibridación los cuatro orbitales de la capa de valencia del carbono se convierten en cuatro orbitales híbridos sp3 de esta forma: Para obtener la hibridación de un átomo se siguen los siguientes pasos: Responda las siguientes cuestiones: Para la molécula NH3 y BF3, indique la hibridación del átomo central, número de orbitales híbridos y número de electrones en cada orbital híbrido. NH3 1. Obtener la estructura de Lewis de la molécula generada mediante un enlace covalente que queremos estudiar. N: 1s2 2s2 2p3 H: 1s1 2. Buscar el número de zonas de enlace que existen en el átomo que se quiere estudiar. Queremos estudiar el átomo central, es decir, el nitrógeno. El nitrógeno tiene cuatro zonas de enlace (los tres enlaces con los tres átomos de hidrógeno y el par de electrones solitario). 3. Obtener la hibridación de este átomo sabiendo que los distintos tipos de hibridación están relacionados con el número de zonas de enlace que presenta un átomo. La hibridación que está relacionada con cuatro zonas de enlace es la sp3. BF3 1. Obtener la estructura de Lewis de la molécula generada mediante un enlace covalente que queremos estudiar. B: 1s2 2s2 2p1 F: 1s2 2s2 2p5 2. Buscar el número de zonas de enlace que existen en el átomo que se quiere estudiar. En nuestro caso estamos buscando la hibridación del átomo central que sería es boro. El boro tiene tres zonas de enlace (los tres enlaces con los átomos de flúor). 3. Obtener la hibridación de este átomo sabiendo que los distintos tipos de hibridación están relacionados con el número de zonas de enlace que presenta un átomo. La hibridación relacionada con tres zonas de enlace es la sp2. La polaridad de un enlace es un parámetro molecular que mide la distribución electrónica en los enlaces. La diferencia de electronegatividad de dos átomos enlazados provoca que los electrones se coloquen más cercanos al átomo más electronegativo. Esto hace que exista una densidad de carga negativa en el átomo más electronegativo y una densidad de carga positiva en el átomo menos electronegativo. El momento dipolar de un enlace en una molécula es un vector que tiene origen en el átomo menos electronegativo y va hacia el más electronegativo. El momento dipolar molecular es la suma vectorial de los momentos dipolares de cada enlace en la molécula. Sí el momento dipolar molecular es diferente de cero la molécula es polar. Para estudiar la polaridad de una molécula seguimos los siguientes pasos: Para sumar los vectores es muy útil pensar que son cuerdas de las que se tira con la misma fuerza. Si el átomo central se mueve la molécula es polar, pero si no se mueve, es apolar. Justifique si la molécula 1. Obtenemos la estructura de Lewis de la molécula. N: 1s2 2s2 2p3 F: 1s1 2s2 2p5 2. Obtenemos la geometría de la molécula. La molécula tiene cuatro zonas de enlace para el átomo central (nitrógeno) y un par de electrones solitarios (el del nitrógeno), por lo que según la TRPECV la geometría será pirámide trigonal. 3. Dibujamos la molécula según su geometría. 4. Dibujamos los momentos dipolares de cada enlace. 5. Sumamos los vectores y obtenemos la polaridad de la molécula. En este caso la suma de los vectores vemos que es un vector hacia abajo, es decir, que los momentos de cada enlace no se anulan. Otra forma de verlo es que si tiramos del nitrógeno en la dirección de las flechas el nitrógeno se mueve, por lo que la molécula es polar. La fuerzas de Van Der Waals son fuerzas de tipo débil y de atracción entre moléculas. Son de tres subtipos: Es un tipo de fuerza presente en enlaces del hidrógeno con átomos pequeños y muy electronegativos (nitrógeno, oxígeno y flúor). Al enlazarse uno de los anteriores elementos con el hidrógeno, el electrón del hidrógeno tiende a estar más cerca del núcleo del otro elemento, generando una densidad de carga positiva cerca del hidrógeno y una densidad de carga negativa cerca del otro elemento. Estas cargas pueden atraer a otros átomos suficientemente pequeños, y el H hace de “puente” uniendo moléculas. El puente de hidrógeno se suele representar con una línea de puntos discontinua entre el hidrógeno y la molécula que es atraída por la densidad de carga de este. Para las moléculas H2O y PF3 indique el tipo de fuerzas intermoleculares. H2O 1. Obtener la estructura de Lewis del H2O H: 1s1 O: 1s1 2s2 2p4 2. Obtener la geometría de la molécula. Esta molécula tiene cuatro zonas de enlace y dos pares de electrones solitarios en su átomo central, por lo que según la TRPECV tendrá geometría angular. 3. Estudiar la polaridad. 4. Ver que tipo de fuerzas intermoleculares existen. La molécula de agua es polar y tiene un átomo de oxígeno (elemento pequeño y muy electronegativo) al hidrógeno, generando puentes de hidrógeno. PF3 1. Obtener la estructura de Lewis del PF3 P: 1s2 2s2 2p6 3s2 3p3 F: 1s1 2s2 2p5 2. Obtener la geometría de la molécula. Esta molécula tiene cuatro zonas de enlace y dos pares de electrones solitarios en su átomo central, por lo que según la TRPECV tendrá geometría pirámide trigonal. 3. Estudiar la polaridad. 4. Ver que tipo de fuerzas intermoleculares existen. La molécula de PF3 es polar y no presenta puentes de hidrógeno al no tener átomos de hidrógeno, por lo que presenta fuerzas de Van der Walls del tipo dipolo permanente – dipolo permanente. Los puntos de fusión y ebullición de una molécula dependen del tipo de enlace intramolecular (iónico, covalente y metálico) que se produce, pero cuando analizamos moléculas covalentes similares hay grandes diferencias por sus fuerzas intermoleculares. Cuanto mayores sean las fuerzas intermoleculares mayores son los puntos de fusión y ebullición. El orden de intensidad de las fuerzas intermoleculares es el siguiente: Las fuerzas dipolo permanente – dipolo inducido van entre las fuerzas de London y las dipolo permanente – dipolo permanente, pero no se van a utilizar para comparar los puntos de ebullición y fusión en el enlace covalente. El punto de fusión y ebullición depende también de la masa molecular, ya que a mayor masa molecular mayor punto de fusión y ebullición. Dos moléculas similares son, por ejemplo, el fluoruro de hidrógeno (HF) y el cloruro de hidrógeno (HCl). Ambas moléculas están formadas por un hidrógeno y un elemento del grupo de los halógenos. En este caso el fluoruro de hidrógeno tendrá mayor punto de fusión y ebullición. Esto se debe a que las dos moléculas son polares, pero el HF presenta puentes de hidrógeno, lo que hace que las moléculas estén más unidas entre sí y cueste más que cambie de estado. Con los datos recogidos en la tabla adjunta, conteste razonadamente a las siguientes preguntas: a) ¿Por qué la temperatura de ebullición normal del HF es mayor que la del HCl? a) La molécula de fluoruro de hidrógeno HF en una molécula con geometría lineal y polar. Además el enlace entre el flúor y el hidrógeno permite la existencia de puentes de hidrógeno. Por otro lado la molécula de cloruro de hidrógeno HCl también tiene geometría lineal y es polar, pero no tiene puentes de hidrógeno porque el cloro es un elemento demasiado grande. Todo esto hace que el HF tenga un punto de ebullición mayor que el HCl porque el HF tiene puentes de hidrógeno. b) La molécula de agua H2O tiene una geometría angular y es polar. Los enlaces entre el oxígeno y los hidrógenos generan puentes de hidrógeno. Por otro lado, el Cl2 tiene una geometría lineal y es apolar, por lo que solo existen fuerzas de London, que son de mucha menor intensidad que los enlaces de hidrógeno del H2O. Todo esto hace que el H2O tenga mayor punto de ebullición que el Cl2.¿Cómo obtenemos la estructura del NO?
![]()
![]()
![]()
![]()
![]()

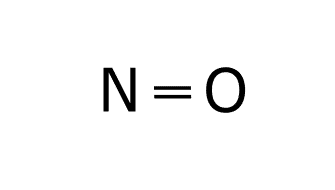
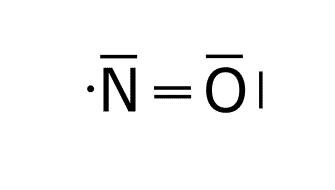
¿Cómo obtenemos la estructura del NO2?
![]()
![]()
![]()
![]()
![]()
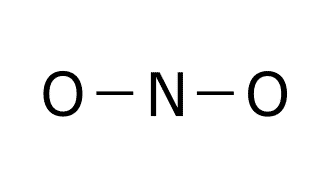
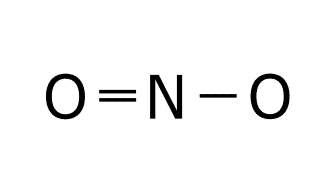
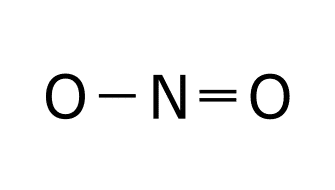
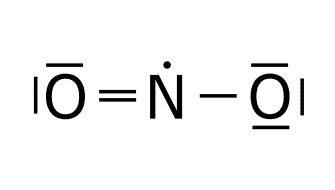
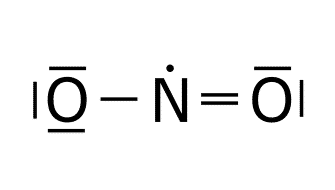
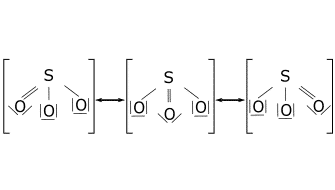
Resonancia.
![]()
![]()
![]()
![]()
![]()
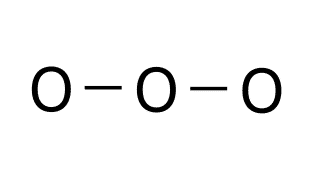
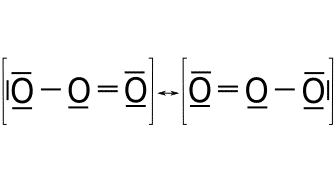
![]()
![]()
![]()
![]()
![]()
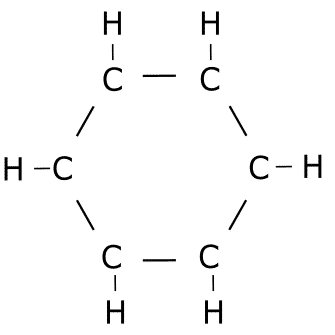
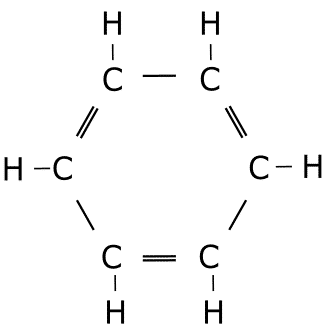
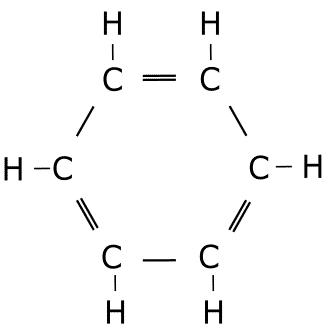
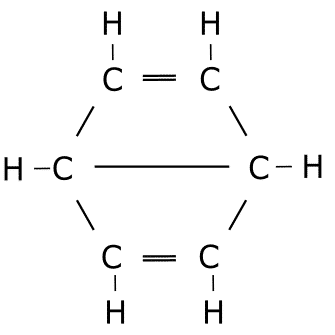
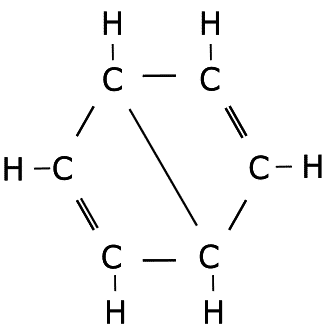
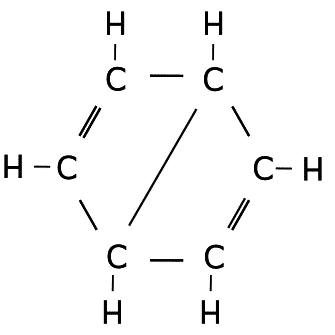

Ejercicio de estructuras resonantes.
![]()
![]()
![]()
![]()
![]()
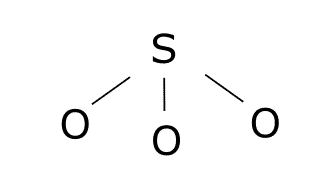
Carga formal.
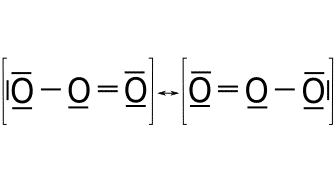
Átomo Electrones de valencia Electrones solitarios Enlaces Carga formal Oxígeno izquierdo 6 6 1 6 – 6 – 1 = -1 Oxígeno central 6 2 3 6 – 2 – 3 = 1 Oxígeno derecho 6 4 2 6 – 4 – 2 = 0 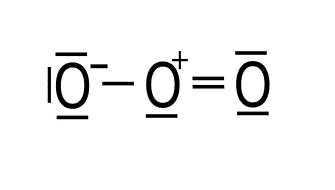
Átomo Electrones de valencia Electrones solitarios Enlaces Carga formal Oxígeno izquierdo 6 4 2 6 – 4 – 2 = 0 Oxígeno central 6 2 3 6 – 2 – 3 = 1 Oxígeno derecho 6 6 1 6 – 6 – 1 = -1 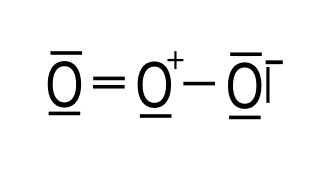
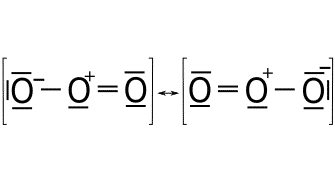
Enlace coordinado dativo.
H3O+
![]() . En esta reacción uno de los pares de electrones solitarios del oxígeno pasa a formar un enlace con el H+ que no tiene electrones. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el oxígeno hasta el hidrógeno.
. En esta reacción uno de los pares de electrones solitarios del oxígeno pasa a formar un enlace con el H+ que no tiene electrones. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el oxígeno hasta el hidrógeno.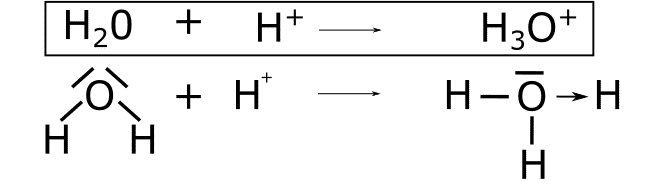
NH4+
![]() . En esta reacción el par de electrones solitarios del nitrógeno pasa a formar un enlace con el H+ que no tiene electrones. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el nitrógeno hasta el hidrógeno.
. En esta reacción el par de electrones solitarios del nitrógeno pasa a formar un enlace con el H+ que no tiene electrones. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el nitrógeno hasta el hidrógeno.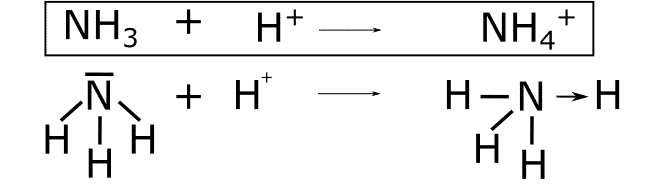
Al2Cl6
![]() . En esta reacción el par de electrones solitarios de uno de los cloros pasa a formar un enlace con el aluminio que no tiene electrones que puedan formar otro enlace. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el cloro hasta el aluminio. En esta molécula se forman dos enlaces coordinados dativos.
. En esta reacción el par de electrones solitarios de uno de los cloros pasa a formar un enlace con el aluminio que no tiene electrones que puedan formar otro enlace. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el cloro hasta el aluminio. En esta molécula se forman dos enlaces coordinados dativos.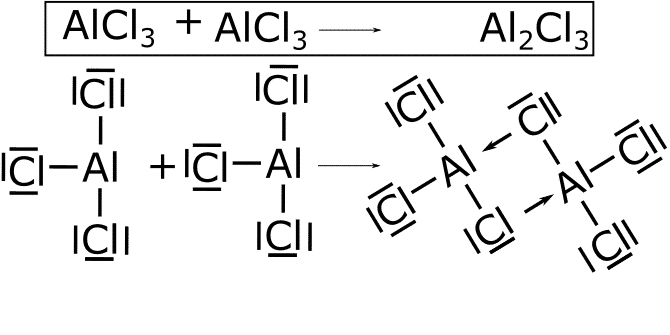
NH3BF3
![]() . En esta reacción el par de electrones solitarios del nitrógeno pasa a formar un enlace con el boro que no tiene electrones que puedan formar otro enlace. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el nitrógeno hasta el boro.
. En esta reacción el par de electrones solitarios del nitrógeno pasa a formar un enlace con el boro que no tiene electrones que puedan formar otro enlace. De esta forma se forma el enlace coordinado dativo que se representa con una flecha desde el nitrógeno hasta el boro.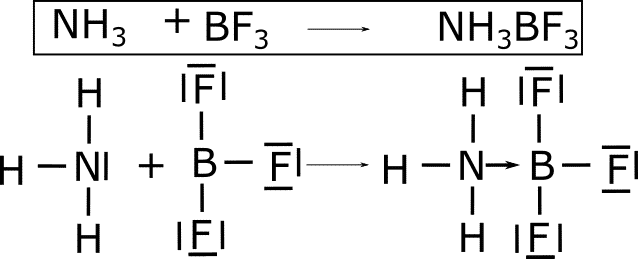
Geometría molecular en el enlace covalente.
Teoría del enlace de valencia (TEV).
Tipos de enlace.
![]() : se produce cuando dos orbitales se solapan frontalmente, siguiendo el eje internuclear (recta que une los núcleos de los átomos en este enlace covalente).
: se produce cuando dos orbitales se solapan frontalmente, siguiendo el eje internuclear (recta que une los núcleos de los átomos en este enlace covalente).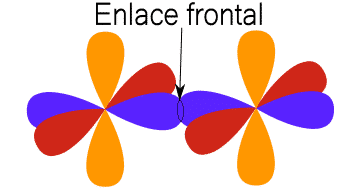
![]() : se produce cuando dos orbitales se solapan lateralmente. Estos orbitales tienen que ser paralelos.
: se produce cuando dos orbitales se solapan lateralmente. Estos orbitales tienen que ser paralelos.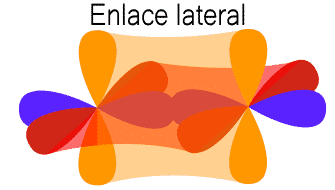
Teoría de repulsión de los pares de electrones de la capa de valencia (TRPECV).
![]()
Tabla con la que obtener la geometría molecular.
Zonas de enlace Pares solitarios Geometría Forma Ángulo 2 0 Lineal ![]()
180º 3 0 Triangular 
120º 1 Angular 
109º 4 0 Tetraédrica 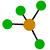
109’5º 1 Pirámide trigonal 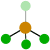
107º 2 Angular 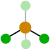
104’5º 5 0 Bipirámide trigonal 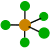
6 0 Octaédrica 
Ejercicio resuelto geometría molecular (TRPECV).
![]()
![]()
![]()
![]()
![]()
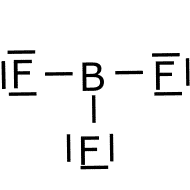

![]()
![]()
![]()
![]()
![]()


Hibridación.
Tipos de hibridación.



¿Cómo se produce la hibridación en un enlace covalente?Justificación del enlace covalente mediante la hibridación.
![]()
![]()
![]()
![]()
![]()

Análisis de la configuración electrónica para el enlace entre el carbono y el hidrógeno.
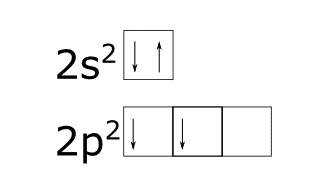
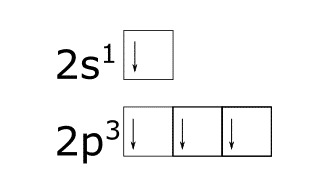
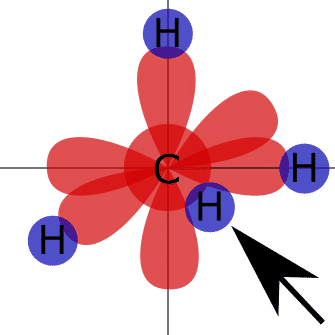
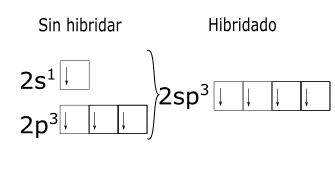
¿Cómo obtener la hibridación de un átomo?
Ejercicio resuelto de geometría molecular (hibridación).
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
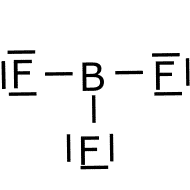
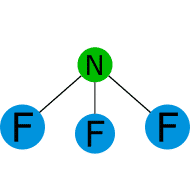
Polaridad.
Ejercicio resuelto de polaridad.
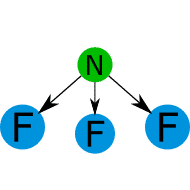
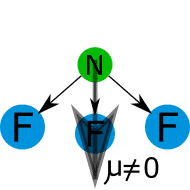
![]() es polar o apolar.
es polar o apolar.![]()
![]()
![]()
![]()
![]()
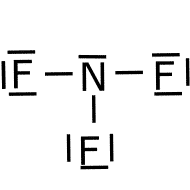
Fuerzas intermoleculares.
Fuerzas de Van der Waals.
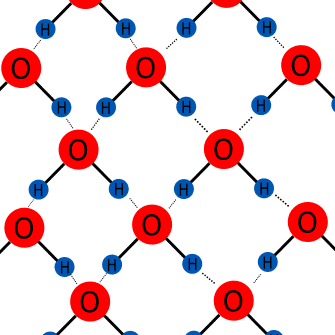
Puentes o enlaces de hidrógeno.
Pasos para analizar las fuerzas intermoleculares.
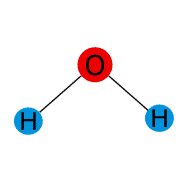
Ejercicio resuelto de fuerzas intermoleculares.
![]()
![]()
![]()
![]()
![]()

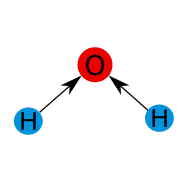
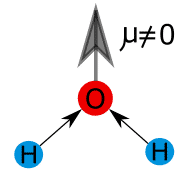
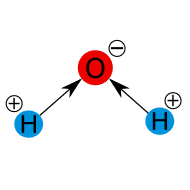
![]()
![]()
![]()
![]()
![]()
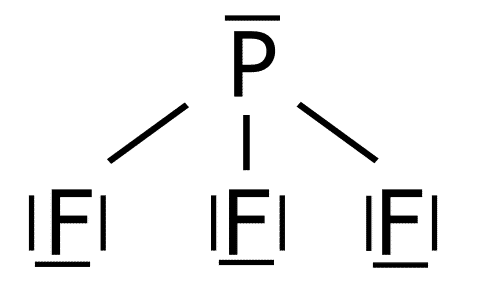
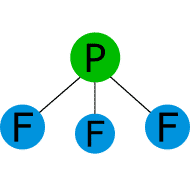
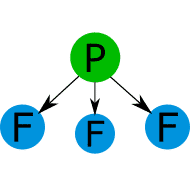
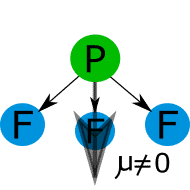
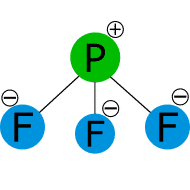
Comparar los puntos de fusión y ebullición de las sustancias covalentes con las fuerzas intermoleculares.
Ejercicio resuelto de propiedades según las fuerzas intermoleculares.
Sustancia H2O HF HCl Cl2 Temperatura de ebullición (ºC) 100 20 -85 -34
b) ¿Por qué la temperatura de ebullición normal del H2O es mayor que la del Cl2?Solución del ejercicio.
![]()