Enlaces covalentes y geometrías moleculares
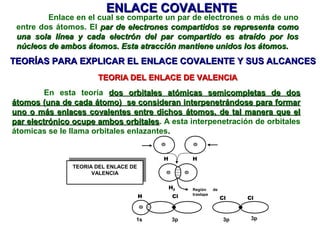
- 1. ENLACE COVALENTE Enlace en el cual se comparte un par de electrones o más de uno entre dos átomos. El par de electrones compartidos se representa como una sola línea y cada electrón del par compartido es atraído por los núcleos de ambos átomos. Esta atracción mantiene unidos los átomos. TEORÍAS PARA EXPLICAR EL ENLACE COVALENTE Y SUS ALCANCES TEORIA DEL ENLACE DE VALENCIA En esta teoría dos orbitales atómicas semicompletas de dos átomos (una de cada átomo) se consideran interpenetrándose para formar uno o más enlaces covalentes entre dichos átomos, de tal manera que el par electrónico ocupe ambos orbitales. A esta interpenetración de orbitales orbitales átomicas se le llama orbitales enlazantes. H H TEORIA DEL ENLACE DE TEORIA DEL ENLACE DE VALENCIA VALENCIA H2 Región de traslape H Cl Cl Cl 1s 3p 3p 3p
- 2. TEORIA DE LOS ORBITALES MOLECULARES En esta teoría los orbitales atómicos de átomos diferentes se combinan para formar nuevos niveles de energía (orbitales moleculares) para toda la molécula. El número de orbitales moleculares formados iguala el número de orbitales atómicos que se combinan. Los electrones ocupan los orbitales moleculares de las moléculas del mismo modo que ocupan los orbitales atómicos de los átomos; es decir, en su estado fundamental, una molécula tiene sus orbitales moleculares de menor energía ocupados. Algunos orbitales moleculares son enlazantes, mientras que otros son antienlazantes. nodo 1s 1s H H H2 orbital de enlace σ 1s
- 3. LA FORMA DE LAS MOLÉCULAS Cuando se escribe la estructura de Lewis para el agua parece que los átomos se disponen en línea recta. .. H: O : H .. Sin embargo, experimentalmente se determina que la forma de la molécula no es lineal. La molécula es angular, como se muestra en la figura. H α d1 O H d2 Se entiende por forma molecular la figura geométrica obtenida al unir los núcleos de los átomos enlazados mediante líneas rectas. Estas líneas rectas representan los enlaces ANGULOS DE ENLACE son los ángulos formados por las líneas que unen los núcleos de los átomos de la molécula LONGITUD DE ENLACE es la distancia entre los núcleos de los átomos que participan en el enlace.
- 4. POLARIDAD DE LOS ENLACES Los pares de electrones que se comparten entre dos átomos distintos por lo regular no se comparten equitativamente. El concepto de polaridad del enlace es útil para describir la proporción en que los electrones se comparten. Un enlace covalente no polar es áquel en el que los electrones se comparten equitativamente entre dos átomos, debido a que ambos tienen electronegatividades iguales. En un enlace covalente polar uno de los átomos ejerce una atracción mayor sobre los electrones de enlace que el otro. Si la diferencia de electronegatividades es muy grande, se forma un enlace iónico. +1.. -1 Na : F : .. Los símbolos δ+ y δ- indican las cargas parciales positiva y negativa, respectivamente
- 5. ENLACES MULTIPLES El hecho de compartir un par de electrones constituye un solo enlace covalente, al que comúnmente se le llama enlace sencillo. H:H H-H En muchas moléculas, los átomos completan un octeto compartiendo más de un par de electrones entre ellos. Cuando dos pares de electrones unen a dos átomos el enlace se llama doble enlace. O::C::O O=C=O Cuando tres pares de electrones se comparten entre dos átomos se forma un enlace triple. N:::N N=N Por regla general, la distancia entre los átomos enlazados disminuye al aumentar el número de pares de electrones compartidos.
- 7. GEOMETRÍAS MOLECULARES La geometría molecular es la distribución tridimensional de los átomos de una molécula. La geometría de una molécula influye en sus propiedades físicas y químicas, como el punto de fusión, el punto de ebullición, la densidad y el tipo de reacciones en que puede participar. MODELO DE LA REPULSIÓN DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA (RPECV) Hay un procedimiento que permite predecir la geometría de las molécula y iones, si se conoce el número de electrones que rodean al átomo central, según la estructura de Lewis. El fundamento de este enfoque es que los pares Lewis de electrones de la capa de valencia de un átomo se repelen entre sí. Esta es sí la TEORIA DE LA REPULSION DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA Se puede predecir la geometría de las moléculas (e iones) de manera sistemática. Para lograrlo es conveniente dividir las moléculas en dos categorías, dependiendo de la presencia o ausencia de pares electrónicos libres en el átomo central.
- 8. La secuencia para predecir geometrías moleculares es la siguiente a) Se dibuja la estructura de Lewis, siguiendo las consideraciones que se estudiraron anteriormente. b) Se cuenta el número de pares de electrones de enlace y no enlazantes alrededor del átomo central y se colocan de forma que minimicen las repulsiones: (ver tabla) c) La geometría molecular final vendrá determinada en función de la importancia de la repulsión entre los pares de electrones de enlace y de no enlace.
- 9. GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE GEOMETRIA DE NUMERO DE ANGULOS NOTACION GEOMETRIA GRUPOS DE LOS GRUPOS DE PARES DE ENLACE EJEMPLO RPECV MOLECULAR ELECTRONES ELECTRONES SOLITARIOS IDEALES
- 10. GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE GEOMETRIA DE NUMERO DE ANGULOS NOTACION GEOMETRIA GRUPOS DE LOS GRUPOS DE PARES DE ENLACE EJEMPLO RPECV MOLECULAR ELECTRONES ELECTRONES SOLITARIOS IDEALES
- 11. GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE GEOMETRIA DE NUMERO DE ANGULOS NOTACION GEOMETRIA GRUPOS DE LOS GRUPOS DE PARES DE ENLACE EJEMPLO RPECV MOLECULAR ELECTRONES ELECTRONES SOLITARIOS IDEALES
- 12. GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE GEOMETRIA DE NUMERO DE ANGULOS NOTACION GEOMETRIA GRUPOS DE LOS GRUPOS DE PARES DE ENLACE EJEMPLO RPECV MOLECULAR ELECTRONES ELECTRONES SOLITARIOS IDEALES
