En continuación a nuestra serie de interacciones moleculares de las cuales pueden ver la primera parte aquí. (Prometo que esta 2da parte será buena). Hay un fenómeno único y particular pero tan común para nosotros que lo pasamos desapercibido. La forma sólida del agua (el hielo) es de los poquísimos sólidos en la naturaleza que es menos denso que su forma líquida. Es decir, el hielo flota sobre el agua. Fascinante, ¿no?
Yo entiendo, claro, no es la más fascinante de las observaciones a simple vista pero, ¿Qué tal si les dijera que solo el agua y otras cinco sustancias más son las únicas en las que su sólido es capaz de flotar sobre su líquido? ¡Solo seis entre los millones de sustancias conocidas!

Enfoquémonos en el agua. El agua es una de las sustancias más estudiadas por los científicos, es base para la vida, tiene un ciclo conocidísimo, es la base para la unidad de temperatura Celsius, interviene en el control climático del planeta y es considerado «el solvente universal». ¿Qué hace al agua tan especial? La molécula de agua está formada por dos átomos de hidrógeno y un átomo de oxígeno. Estos dos elementos aportan sus características para hacer del agua la fascinante sustancia que es.
Primero, el oxígeno. El oxígeno es un elemento que tiene mucha afinidad por los electrones, con alto poder oxidante debido a esto, en su forma atómica, el oxígeno tiene 6 electrones de valencia, le hacen falta dos electrones para completar el octeto por lo que generalmente lo van a encontrar siempre en estado de oxidación -2, es decir, que ha secuestrado 2 electrones. El oxígeno puede formar enlaces covalentes, donde los electrones se comparten entre el oxígeno y el otro átomo, o bien, puede formar enlaces iónicos, en el cual, el oxígeno acompaña a un metal quitándole dos electrones y tomando una carga forma negativa -2. La afinidad de un elemento a atraer electrones se conoce como electronegatividad. Todos los elementos tienen electronegatividad pero algunos más que otros y oxígeno es de los que más electronegatividad tiene.
Por otro lado, el hidrógeno. El hidrógeno solo posee un electrón de valencia y necesita un solo electrón para completar su capa de valencia y obtener así la configuración electrónica del helio lo cual lo mantendría estable. Pero a diferencia del oxígeno, el hidrógeno tiene una electronegatividad moderada y no puede secuestrar electrones tan indiscriminadamente como lo hace el oxígeno. Por lo general, vamos a encontrar al hidrógeno haciendo enlaces simples covalentes, en pocas ocasiones el hidrógeno forma enlaces iónicos. Otra característica del hidrógeno importante para este artículo es que el hidrógeno sólo tiene un electrón. No tiene otros electrones internos que puedan esconder el núcleo del átomo. Como han de saber, en el núcleo del átomo se encuentran los protones los cuales tienen cargas positivas y en el caso del hidrógeno, este solo tiene un protón. Cuando el hidrógeno pierde su electrón, el núcleo que solo se compone de un protón, queda absolutamente expuesto, de hecho, en química nos referimos a él como «el protón» y no como el ión H+.
Cuando dos átomos de hidrógeno se enlazan a un átomo de oxígeno, el hidrógeno resiente el hecho de que el oxígeno sea muy electronegativo. Estos dos elementos forman enlaces covalentes, es decir, comparten los electrones pero dado que el oxígeno es tan electronegativo, este es egoísta y atrae hacia él los electrones con más fuerza y los acerca más a su núcleo. Esto hace que los hidrógenos dejen expuesto su núcleo, es decir, el protón que tienen en el núcleo. Esto se percibe como un desbalance de cargas a lo cual se le llama dipolo. Sin embargo, este dipolo es particular, es muy pronunciado.
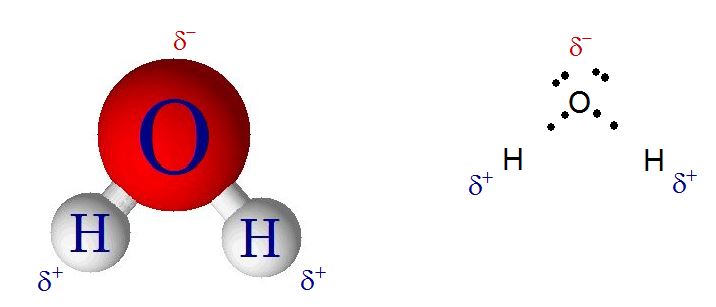
¿Qué son esos puntitos en las moléculas? Son los electrones, así se representan, como puntos. Recordemos que los electrones tienen carga negativa y se mueven a altísima velocidad alrededor de los núcleos, como el oxígeno atrae los electrones con más fuerza, entonces los electrones están más cercanos a él y por ello le confieren una carga parcial negativa en cada enlace dejando el núcleo del hidrógeno expuesto, tal y como dijimos en el párrafo anterior. Aparte de eso, el oxígeno tiene dos pares de electrones libres, son de él y estos habitan alrededor del núcleo ajenos a lo que pasa en los enlaces con el hidrógeno. Estos pares de electrones libres tienen también carga negativa y pueden sentirse atraídos por interacciones de coulomb hacia cargas positivas (las cargas positivas se sienten atraídas por cargas negativas y viceversa). Como comentamos antes, el núcleo del hidrógeno es un protón con carga positiva y como le han despojado de su electrón prácticamente está expuesto, mostrando su carga positiva a esos pares de electrones libres del oxígeno. Con esto entonces, los oxígenos de las moléculas de agua se orientan de forma que puedan interactuar con los protones de otras moléculas de agua por medio de atracción de coulomb.
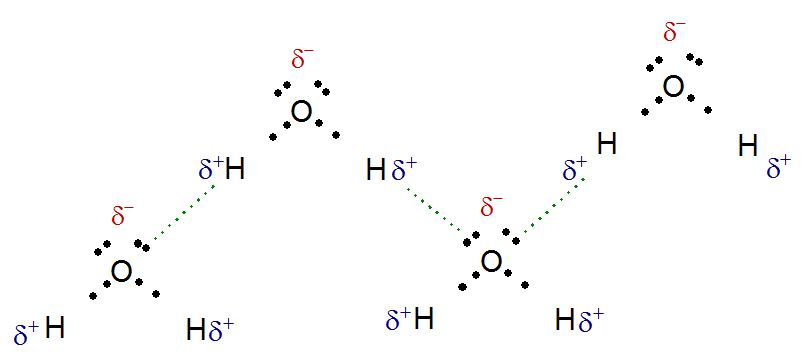
Así entonces, el protón que antes estaba solo, ahora tiene la posibilidad de interactuar con los electrones libres del oxígeno de una molécula de agua adyacente y con los electrones de su enlace covalente. Esto es una interacción dipolo-dipolo tan especialmente fuerte que se cataloga como una interacción intermolecular aparte y se le llama puente de hidrógeno, pues porque pareciera que el hidrógeno hace un puente entre dos oxígenos.
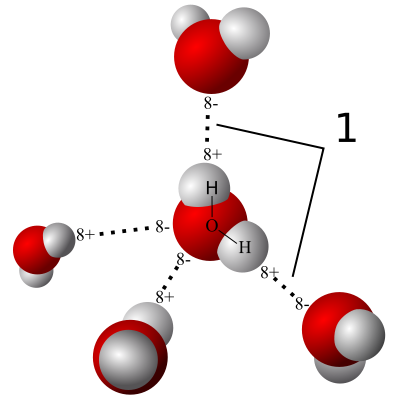
Esta interacción entre las moléculas de agua, como pueden imaginar, tiene repercusiones en las propiedades físicas de la sustancia. Por ejemplo, esta es la razón por la cual el agua tiene una viscosidad tan inusualmente alta, pues sus moléculas se mueven menos libremente en el líquido debido a esta interacción de puente de hidrógeno. También esto explica la razón por la cual el punto de ebullición del agua es tan inusualmente alto. Cuando una sustancia ebulle, a nivel molecular lo que ocurre es que el calor que se adiciona a la sustancia se usa para darle energía cinética a las moléculas, esta es energía de movimiento. Si se le añade suficiente energía, las moléculas se mueven con tal velocidad que pueden vencer las atracciones electrostáticas del puente de hidrógeno y pasar a la fase gaseosa pues ya nada las retiene en el líquido y nosotros esto lo percibimos como ebullición. Como los puentes de hidrógeno son fuerzas intermoleculares tan fuertes, entonces se necesita mucha energía para vencer estas fuerzas lo cual nosotros vemos como una gran temperatura. Esto es cierto para toda sustancia que tenga estos puentes de hidrógeno, por ejemplo, la glicerina que tiene la posibilidad de formar 3 puentes de hidrógeno tiene un punto de ebullición de 290 °C.
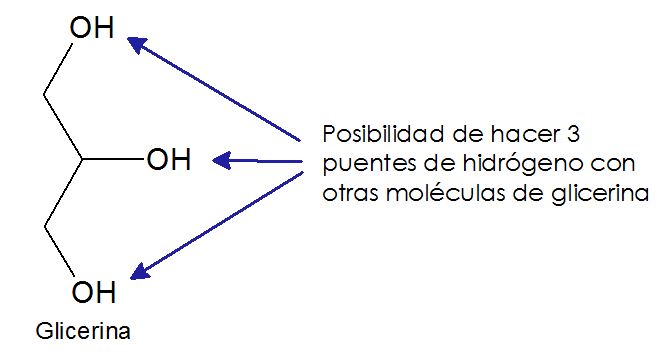
Y estos puentes de hidrógeno explican porque el hielo tiene una densidad menor que la del hielo. Vamos a ver si nos podemos explicar. El hielo es un sólido en el cual sus moléculas se tienen que acomodar en un cristal que tiene optimizadas todas las interacciones intermoleculares. En el caso del hielo, estas intereacciones son los puentes de hidrógeno, los cuales se acomodan de forma que todas las moléculas sienten esta interacción.
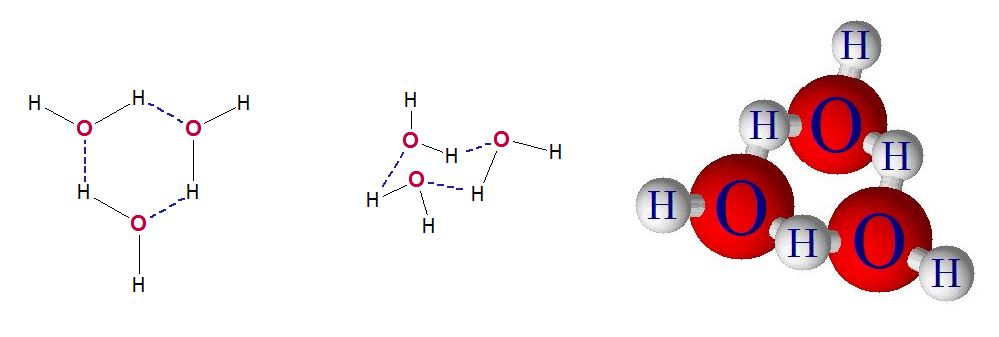
La distancia entre el hidrógeno y el oxígeno en un puente de hidrógeno es cerca de 200 pm mientras que el enlace covalente entre el hidrógeno y el oxígeno en una molécula de agua es de 110 pm, por tanto, el acomodo de las moléculas de agua en el cristal del sólido optimiza las interacciones de puente de hidrógeno pero al hacerlo se van generando «huecos», espacios vacíos en el cristal, debido a estas diferencias en las longitudes de enlace. Este espacio vacío antes no estaba cuando el agua era líquida, pues las moléculas podían acercarse más unas a las otras gracias a su energía cinética, pero en el sólido, tal cosa no es posible, las moléculas de agua deben acomodarse en el cristal, este espacio vacío precisamente provoca que el hielo sea menos denso que el agua, este espacio vacío es precisamente lo que hace que el hielo flote sobre su líquido, este espacio vacío es la causa de que se hundiera el Titanic pues por esta razón es que un iceberg puede flotar sobre el agua. Este mismo espacio vacío hace posible la vida en los ríos y lagos en los hemisferios norte y sur del planeta pues cuando llega el invierno, el agua se congela desde arriba en la superficie hacia abajo dejando siempre una porción de agua sin congelar en la parte inferior, es en esta parte líquida donde los peces y otros organismos acuáticos pueden vivir. Si el agua no hiciera este fenómeno (de disminuir su densidad al congelarse debido a los espacios vacíos que las moléculas de agua forman al formar el cristal de hielo) el agua se congelaría del fondo hacia arriba, encerrando en el sólido a todos los animales y plantas que habitan en el lecho de los ríos y lagos imposibilitando siquiera su existencia. La oxigenación del agua en estos ríos y lagos congelados es tema de otro blog.
Ahora bien, el puente de hidrógeno no es exclusivo del enlace O – H, de hecho, es posible que se forme con los elementos más electronegativos de la tabla periódica, estos son el nitrógeno, el oxígeno y el flúor. Se conoce de otros casos en que se pueden formar puentes de hidrógeno con características más especiales y hablaremos de ello en otro momento.
Ahora comparemos. ¿Cuánta energía necesita un mol de puentes de hidrógeno para separarse? Bien, la energía de un enlace covalente de H – O es de 464 kJ/mol mientras que el puente de hidrógeno tiene una energía de 25 kJ/mol. Si, lo sé, no parece ser mucho, pero si comparamos con las interacciones dipolo – dipolo donde no existen puentes de hidrógeno, la energía para separar estas interacciones es de cerca de 5 kJ/mol. Así, un puente de hidrógeno es 5 veces más fuerte que una interacción dipolo-dipolo. Si lo comparamos con la interacción ión-ión en las cuales hay cargas formales separadas, estas tienen una energía típica de 250 kJ/mol. Así, las interacciones ión-ión son 10 veces más fuertes que los puentes de hidrógeno. Para esto, mejor hagamos una tabla.
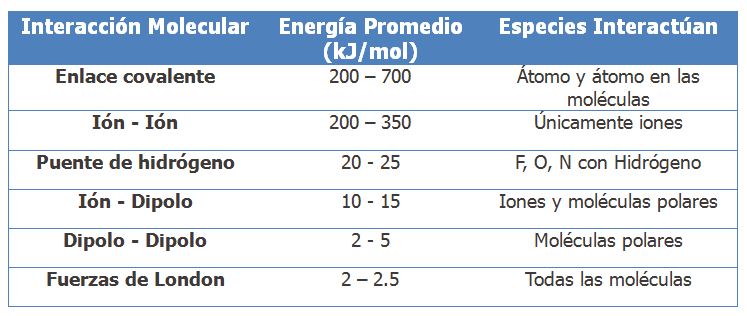
Así entonces, los puentes de hidrógeno son las interacciones intermoleculares más importantes después de la interacción entre iones.
¿Qué se necesita para formar puentes de hidrógeno? Bien, se necesita hidrógeno, obvio, pero este hidrógeno debe estar enlazado a un átomo MUY electronegativo. Por tanto, se necesita un átomo que cumpla esta característica y estos son el nitrógeno, el oxígeno y el flúor. Por último, se necesitan pares de electrones libres que interactúen con el hidrógeno. Algunos ejemplos de moléculas que pueden formar puentes de hidrógeno (entre un sinfín que existen):
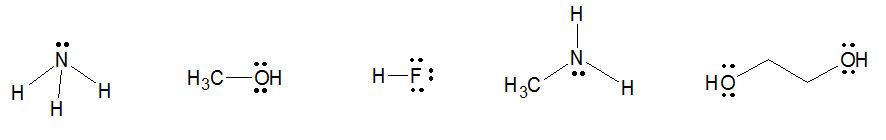
En otra entrada profundizaremos más en esto. Para mientras, pueden ver esta entrada acerca de ¿Por qué la sal se disuelve en el agua? Y ¡que el legado continúe!
LEHP
Referencias
- Fuerzas Intermoleculares. College of Saint Benedict & Saint Johns University. Consultado 25 de abril, 2017
- Arunan, E.; et. al. Definition of the Hydrogen Bond. Pure Appl. Chem. 2011, 83 (8), 1637.
- Emsley, J. Very Strong Hydrogen Bonds. Inorganic Chemistry. 1980, 9 (1), 91.
- Wade, L. Química Orgánica. 7a Edición, Pearson Educación, México DF, 2011.
- McMurry, J. Química Orgánica. 7a Edición, Cengage Learning, México DF, 2008.
Imágenes
Todas las imágenes son propiedad intelectual de El Legado de Newton a excepción de la figura No. 5 la cual se acredita a:
Qwerter at Czech wikipedia: Qwerter. Transferred from cs.wikipedia; Transfer was stated to be made by User:sevela.p. Translated to english by by Michal Maňas (User:snek01). Vectorized by Magasjukur2 – File:3D model hydrogen bonds in water.jpg, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=14929959


Excelente blog! Gracias!
Me gustaMe gusta
Excelente blog gracias!
Me gustaMe gusta