En esta entrada haremos una introducción a uno de los grupos de materiales más importantes dentro de la industria y del sector de la automoción, los metales. Para ello empezaremos con lo básico de la química para entender mejor su estructura para más adelante analizar sus propiedades, aleaciones y aplicaciones en la industria.
Enlace Químico
Para entender como van unidos los átomos debemos comprender que es un compuesto químico. Un compuesto químico es una sustancia formada por dos o más elementos diferentes mediante un enlace químico en proporciones definidas. Por tanto podemos definir el enlace químico como la unión de dos o más átomos con el fin de alcanzar una estabilidad (configuración del gas noble) en cuanto electrones se refiere, ya que éstos pueden desplazarse de unos átomos a otros o incluso compartirse.
Las propiedades periódicas tales como la energía de ionización, afinidad electrónica o la electronegatividad nos permiten clasificar los enlaces en tres tipos:
- Enlace iónico: Es el que se produce entre átomos de diferente carga eléctrica. Se forma cuando el átomo cargado negativamente cede los electrones y el positivo los gana. Este enlace se da entre un metal y un no metal.
- Enlace covalente: Es el enlace que se da entre los no metales. Ambos no metales comparten uno o mas electrones para alcanzar la estabilidad.
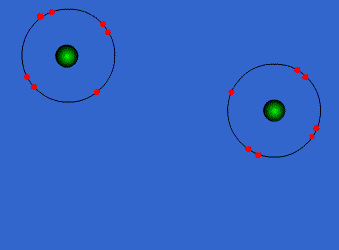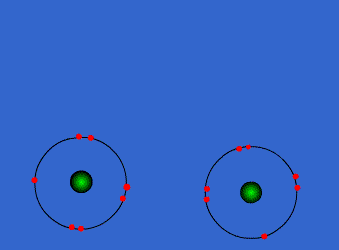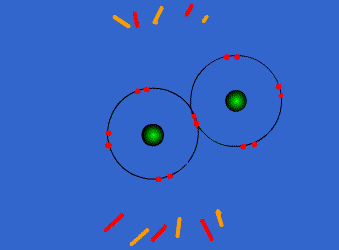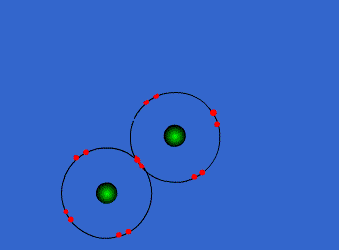
- Enlace metálico: Se produce cuando se combinan metales entre sí. Los átomos de los metales necesitan ceder electrones para alcanzar la estabilidad. En este caso, los metales pierden los electrones y se forma una nube de electrones entre los núcleos positivos.
Enlace Metálico
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras (FCC) o la cúbica centrada en el cuerpo (BCC), como veremos más adelante. Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales.
Este enlace sólo puede estar en sustancias en estado sólido. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes.
Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes( iones positivos o falta de electrones). Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen.
El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad. Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones.
Este enlace sólo puede estar en sustancias en estado sólido. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes.
Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes( iones positivos o falta de electrones). Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen.
El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad. Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones.
Característica de los materiales metálicos
Los metales tienen una serie de características que los diferencian de los demás materiales, los no metales. Además de que todos, a excepción del mercurio , son sólidos a temperatura ambiente, la más característica de las propiedades de los metales es su brillo especial, que curiosamente se llama brillo metálico. El brillo es la capacidad de un material para reflejar, absorber o reflectar la luz. Los metales, una vez pulidos, reflejan la mayor parte de la luz que les llega.
Otra característica que cumplen casi la totalidad de los metales es ser buenos conductores eléctricos. La estructura electrónica de los átomos metálicos se caracteriza por la existencia de pocos electrones en su capa externa, por lo que se requiere escasa energía para que los pierdan y adopten la estructura estable. Así muchos son empleados para hacer cables, etc... Además también son buenos conductores del calor.
Los metales son materiales, en general, bastante densos, insolubles en agua y en muchos disolventes, y opacos con un espesor adecuado.
En cuanto a las propiedades mecánicas podemos decir que los metales presentan resistencia a la tracción, es decir, que pueden soportar grandes cargas ( como vimos entradas pasadas ).
Los metales son poco duros, así una de las funciones más importantes de las aleaciones es mejorar esta propiedad.
Los metales son muy dúctiles, es decir, que se pueden estirar en forma de hilos; y bastante maleables, podemos estirarlos en láminas sin romperlos. Una de las malas propiedades de los metales es su baja resistencia a la fatiga, o la situación en la que se encuentran algunos metales tras ser expuestos a ciclos de carga de una intensidad menor al crítico de rotura del material.
Entre las características en el carácter químico no se puede establecer una relación común a todos los metales ya que, por ejemplo, en el caso de la oxidación, nos encontramos con una gran diferencia en tiempo como en la energía liberada. Existen metales inoxidables como el oro y los hay que tardan menos de un día en oxidar su capa exterior a un milímetro de profundidad como el hierro, el cobalto y el bario.
Entre las características en el carácter químico no se puede establecer una relación común a todos los metales ya que, por ejemplo, en el caso de la oxidación, nos encontramos con una gran diferencia en tiempo como en la energía liberada. Existen metales inoxidables como el oro y los hay que tardan menos de un día en oxidar su capa exterior a un milímetro de profundidad como el hierro, el cobalto y el bario.
Metalografía
Como ya hemos mencionado, los metales en su estado natural son sólidos, es decir, sus partículas están en contacto entre sí, en posiciones fijas y con fuertes atracciones mutuas. Poseen estructura cristalina ( formada por redes cristalinas), sus átomos están empaquetados en patrones tridimensionales regulares y repetitivos.
Si hacemos la mínima subdivisión de la red cristalina que conserve las características de toda la red obtendremos la celda unidad. Existen 14 tipos de celdas unitarias o también llamadas Redes de Bravais.
Los cristales metálicos son generalmente cúbicos simples(CS), cúbicos centrados en las caras(FCC), cúbicos centrados en el cuerpo (BCC) o hexagonales compactos.
El conjunto de las redes cristalinas forman los cristales o granos. El tamaño del grano influye bastante en las propiedades mecánicas de los metales. A temperatura ambiente un tamaño de grano grande por lo general se asocia con una baja resistencia, una baja dureza y una baja ductilidad. Los granos grandes, particularmente en los metales laminados, causan una apariencia superficial áspera una vez que el metal ha sido estirado.
Las fronteras de granos son la que separan los diferentes granos. Tienen una influencia importante en la resistencia y ductilidad de los metales. También influyen en el endurecimiento por deformación dado que interfieren con el movimiento de las dislocaciones. Estos efectos dependen de la temperatura, la rapidez de deformación, y del tipo y cantidad de impurezas presentes a lo largo de las fronteras de grano.
 |
| Red cristalina |
Si hacemos la mínima subdivisión de la red cristalina que conserve las características de toda la red obtendremos la celda unidad. Existen 14 tipos de celdas unitarias o también llamadas Redes de Bravais.
Los cristales metálicos son generalmente cúbicos simples(CS), cúbicos centrados en las caras(FCC), cúbicos centrados en el cuerpo (BCC) o hexagonales compactos.
El conjunto de las redes cristalinas forman los cristales o granos. El tamaño del grano influye bastante en las propiedades mecánicas de los metales. A temperatura ambiente un tamaño de grano grande por lo general se asocia con una baja resistencia, una baja dureza y una baja ductilidad. Los granos grandes, particularmente en los metales laminados, causan una apariencia superficial áspera una vez que el metal ha sido estirado.
Las fronteras de granos son la que separan los diferentes granos. Tienen una influencia importante en la resistencia y ductilidad de los metales. También influyen en el endurecimiento por deformación dado que interfieren con el movimiento de las dislocaciones. Estos efectos dependen de la temperatura, la rapidez de deformación, y del tipo y cantidad de impurezas presentes a lo largo de las fronteras de grano.
Materiales metálicos
Como adelantamos en la introducción los materiales metálicos son de gran uso en la industria. Estos metales no se emplean tal y como se encuentran en la naturaleza sino que se combinan con otros para mejorar sus propiedades, lo que se denominan aleaciones. En esta ocasión hablaremos de las más importantes, los aceros y el aluminio.Para comenzar mostraremos una tabla donde se encuentran los metales más importantes y su densidad.
Acero
Las aleaciones de mayor empleo en la industria son las aleaciones férreas: Las aleaciones férreas, que aunque pueden añadirse más metales, están constituidas por hierro y un pequeño porcentaje de carbono. Las aleaciones férreas se clasifican mayoritariamente en dos: los aceros y las fundiciones. Se determinan si son de un tipo u otro según el porcentaje de carbono. En los aceros el porcentaje está en torno al 0.05% y el 2% mientras que en las fundiciones entre el 2% y el 4%.En la siguiente tabla se muestran las diferentes aleaciones férreas que nos podemos encontrar.
Según el tipo de aleación que sea su estructura crsitalográfica varía.
Aplicaciones
Los aceros ordinarios tienen como aplicaciones en las carrocerías de los coches, vigas, láminas para tuberías, edificios y puentes, lastas estañadas.
Los de alta resistencia y baja aleación en puentes torres, recipientes a presión, columnas de soporte para altos edificios.
Los aceros medios en carbono se utilizan en ruedas y carriles para trenes, engranajes, cigüeñales, pernos, ejes, pistones.
Los aceros altos en carbono, tienen la particularidad de ser muy duros por lo que se aplican en herramientas de corte (cuchillos, navajas, hojas de corte), matrices y troqueles, brocas.
Los aceros inoxidables que destacan por su resistencia en la corrosión en muchos ambientes se utilizan en tubos de escape, válvulas, turbinas de gas, instrumental quirúrgico, cubertería, aviones...
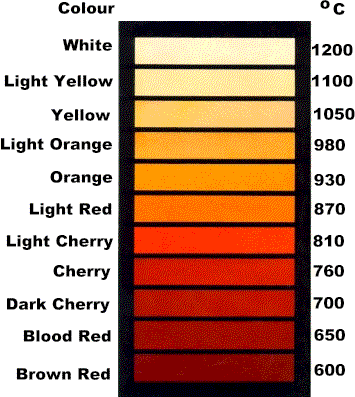
El acero tiene aproximadamente como punto de fusión en torno a 1510º C que es la temperatura de fusión del hierro, su mayor componente. Este dato puede variar más o menos según el tipo de aleación anteriormente visto. Antes de que llegue a alcanzar la temperatura de fusión el acero va variando de color en relación a la temperatura atendiendo a la siguiente tabla.
Aluminio
 |
| Bauxita |
Sus aleaciones más comunes son con cobre (Al-Cu), silicio (Si-Al), zinc (Al-Zn), magnesio (Al-Mg) y manganeso (Al-Mn).
Sus aplicaciones más frecuentes son las aeronáuticas, piezas de motores, marcos ventanales, latas de refresco...
Para finalizar hemos visto que el mundo de los metales es muy amplio y ésto sólo ha sido la primera introducción de todo el estudio que los metales pueden abarcar.
¡Hasta la próxima!